2002, INRA Prod. Anim., 15, 247-265.
Le cuivre dans l'alimentation du porc : oligo-élément essentiel,
facteur de croissance et risque potentiel pour l'Homme et
l'environnement
C. JONDREVILLE 1, P.S. REVY 1, A. JAFFREZIC 2, J.Y. DOURMAD 1
1 INRA Unité Mixte de Recherches INRA-ENSAR sur le Veau et le Porc, 35590 Saint-Gilles
2 INRA Unité Mixte Recherches INRA-ENSAR Sol, Agronomie, Spatialisation - 65, rue de Saint-Brieuc, 35042 Rennes cedex
Catherine.Jondreville@rennes.inra.fr
La quantité de cuivre apportée au porc par son alimentation est souvent
excessive par rapport à ses besoins. Cette pratique génère des lisiers
riches en cuivre dont l'épandage pourrait entraîner des phénomènes de
phytotoxicité dans certaines régions d'élevage. Réduire les apports
alimentaires de cuivre constitue une voie de choix pour en limiter les
rejets. Cette approche nécessite cependant une connaissance approfondie
des fonctions physiologiques du cuivre ainsi que des facteurs de
variation de sa biodisponibilité.
Résumé
|
Abstract |
Fichier PDF (563 Ko)
+ erratum : dans la figure 4, le coefficient de x2 est 0,0105 et non 0,105
Introduction
1 / Fonctions physiologiques, métabolisme et homéostasie du cuivre
1.1 / État, propriétés et fonctions physiologiques du cuivre
1.2 / Métabolisme et homéostasie
1.3 /Carence et toxicité
2 / Le cuivre : facteur de croissance
2.1 / Modes d'action possibles du cuivre comme facteur de croissance
2.2 / Conséquences de l'utilisation du cuivre comme facteur de croissance
3 / Biodisponibilité du cuivre : interactions avec les constituants de la ration
3.1 / Interactions avec les autres minéraux
3.2 / Interactions avec les composants organiques de la ration
4 / Sources d'apport de cuivre dans l'alimentation du porc
4.1 / Sources minérales
4.2 / Sources organiques
5 / Cuivre et environnement
5.1 / Conséquences environnementales de l'épandage de lisier de porc riche en Cu
5.2 / Impact de la réduction du Cu alimentaire sur les rejets de Cu
Conclusion
Références
|
Figures
|
Tableaux
Résumé
Le Cu est un oligo-élément essentiel qui participe à de
nombreuses fonctions physiologiques dont le métabolisme du Fe, la
fonction immunitaire et la protection contre les stress oxydants. Le
foie joue un rôle central dans le métabolisme et l'homéostasie du
Cu : selon les apports et le statut de l'animal, le Cu est stocké,
excrété via la bile ou distribué vers les organes. Les besoins
nutritionnels en Cu du porc en croissance sont inférieurs à 10 mg/kg
d'aliment et peuvent théoriquement être couverts par les seules
matières premières, sans supplémentation. Cependant, utilisé pour ses
propriétés de facteur de croissance, le Cu est introduit à 150 à 250
ppm dans l'aliment du porcelet en post-sevrage et permet d'en améliorer
la vitesse de croissance. Cette pratique est sans incidence sur la
qualité des produits consommés par l'Homme, si elle est limitée à la
seule période de post-sevrage. Elle a cependant pour conséquence
d'augmenter les quantités de Cu appliquées lors de l'épandage des
lisiers de porc et conduit à une accumulation de cet élément dans les
sols.
L'une des solutions pour réduire les rejets de Cu est d'en limiter les
apports alimentaires au niveau du besoin. Cette approche nécessite de
bien connaître et de hiérarchiser les composants alimentaires
susceptibles d'influer significativement sur la disponibilité du Cu.
Certains agents complexants, comme les phytates, les fibres ou les
matières grasses ainsi que certains éléments minéraux, comme le Zn et
le Ca sont en effet des facteurs de variation possibles de la
disponibilité du Cu. Leur impact sur les besoins reste cependant à
évaluer, de même que les critères d'évaluation du statut en Cu restent
à préciser.
Introduction
Le cuivre (Cu) est un composant corporel mineur du porc qui en contient moins de 200 mg à 100 kg de poids vif (Kirchgessner et al
1994, Mahan et Newton 1995, Mahan et Shields 1998), répartis dans le
squelette (40 à 46%), dans le muscle (23 à 26%), dans le foie (8 à
10%), dans le cerveau (9%), dans le sang (6%) et dans les autres
organes internes (3%) (Linder 1991, cité par Cromwell 1997, Buckley
2000). Le Cu est cependant un oligo-élément essentiel qui participe à
de nombreuses fonctions physiologiques dont l'intégrité ne peut être
maintenue qu'en assurant un apport alimentaire suffisant de Cu. Les
matières premières couramment utilisées dans l'alimentation du porc
permettent théoriquement de couvrir ses besoins (Underwood et Suttle
1999) qui n'excèdent pas 5-6 mg/kg d'aliment selon le NRC (1998).
Pourtant, dans la pratique, les aliments pour les porcs sont
supplémentés en Cu. Dans certains cas, cette supplémentation correspond
à une marge de sécurité destinée à pallier notre connaissance
imparfaite d'une part des besoins de l'animal et d'autre part des
facteurs alimentaires susceptibles de faire varier la biodisponibilité
du Cu apporté dans la ration. Dans d'autres cas, notamment dans
l'alimentation du porcelet en post-sevrage, le Cu est utilisé comme
facteur de croissance et est incorporé à des niveaux 30 fois supérieurs
aux besoins. De telles pratiques conduisent à la production de lisiers
riches en Cu dont l'épandage pose des problèmes d'ordre
environnemental. En effet, peu lessivable, le Cu s'accumule dans les
sols et des phénomènes de phytotoxicité pourraient apparaître à moyen
terme dans certaines régions d'élevage intensif (Coppenet et al
1993). Une réduction des apports de Cu dans l'alimentation du porc
serait un moyen de diminuer ces risques environnementaux. Une telle
réduction de l'apport doit cependant s'accompagner de précautions de
façon à éviter toute détérioration des performances et/ou de la santé
des animaux. Avant de s'engager dans cette voie, une connaissance aussi
précise que possible des composantes du besoin en Cu du porc et des
facteurs de variation de sa biodisponibilité est indispensable.
L'objectif de cet article est tout d'abord de faire le point sur les
fonctions physiologiques et le métabolisme du Cu et de décrire les
manifestations de carence ainsi que de toxicité liées à l'apport
alimentaire de cet oligo-élément. Nous aborderons ensuite les
conditions d'utilisation du Cu comme facteur de croissance dans
l'alimentation du porc, son mode d'action comme stimulateur de la
croissance et les conséquences de cette pratique sur la qualité des
produits. A partir de l'analyse des principaux facteurs de variation
alimentaires de la biodisponibilité du Cu, fondée sur l'étude des
interactions entre le Cu et d'autres éléments, minéraux ou organiques,
de la ration, nous examinerons les conditions alimentaires susceptibles
de conduire à des risques de carence en cas d'apport faible en Cu. De
même, les possibilités d'amélioration de la disponibilité du Cu par
l'usage de sources organiques seront discutées. Enfin, nous évaluerons
les conséquences environnementales de différentes conditions d'apport
de Cu dans l'alimentation du porc.
1 / Fonctions physiologiques, métabolisme et homéostasie du cuivre
Le Cu est un oligo-élément essentiel qui entre dans la
composition ou est un co-facteur de nombreuses enzymes (Underwood et
Suttle 1999). La connaissance de son métabolisme et des fonctions
physiologiques dans lesquelles il est impliqué est un préalable
indispensable à l'établissement des besoins en cet oligo-élément.
1.1 / État, propriétés et fonctions physiologiques du cuivre
In vitro, le Fe et le Cu à l'état ionique sont capables de catalyser la formation de dérivés réduits de l'oxygène, ion superoxyde (O2.-), peroxyde d'hydrogène (H2O2)
et radicaux hydroxyle (.OH). Ces dérivés de l'oxygène sont très
toxiques pour la cellule, puisqu'ils peuvent provoquer l'induction et
la propagation de la peroxydation des lipides, en particulier celle des
acides gras polyinsaturés des membranes cellulaires (Strain 1994, Evans
et Halliwell 2001). In vivo, la forme ionique du Cu est très
largement minoritaire et le Cu est majoritairement lié à des
cuproprotéines. Sous cette forme, le Cu exprime ses fonctions, dont
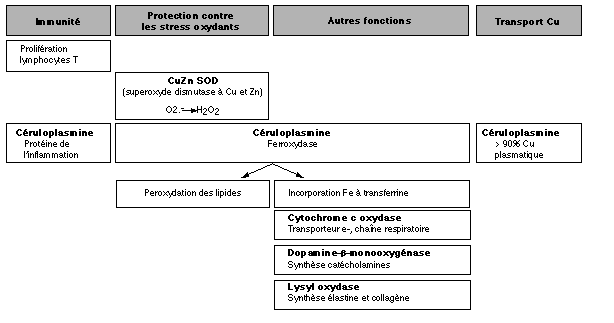
celle de défense de l'organisme contre les stress oxydants (figure 1 ; Cousins 1985, Prohaska 1990, Underwood et Suttle 1999).
La superoxyde dismutase (SOD), cytoplasmique ou extra cellulaire, est
une enzyme contenant à la fois du Cu et du Zn. Elle contribue à la
protection des cellules contre l'ion superoxyde en catalysant sa
dismutation en peroxyde d'hydrogène (Prohaska 1990, Underwood et Suttle
1999). De plus, la synthèse de la glutathion peroxydase à sélénium (Se)
et celle de la ferroenzyme catalase, autres enzymes du système
antioxydant qui détoxifient le peroxyde d'hydrogène en eau, seraient
régulées par le Cu (Strain 1994). La céruloplasmine, globuline
contenant 8 atomes de Cu, représente plus de 90% du Cu circulant dans
le plasma (Cousins 1985). Synthétisée dans le foie, elle assure le
transport du Cu vers les organes via le plasma sanguin et serait
impliquée dans le transport du Cu de la mère au fœtus (Richards 1999).
La céruloplasmine joue un rôle dans l'érythropoïèse en assurant la
catalyse de l'oxydation de Fe2+, tel qu'il est présent dans les hépatocytes, en Fe3+,
préalable indispensable à son intégration dans la transferrine (Cousins
1985). Elle favoriserait également l'incorporation de Fe dans une
protéine de réserve, la ferritine (Underwood et Suttle 1999). Selon
certains auteurs, en limitant la production de composés oxygénés
réactifs lors de l'oxydation du Fe ferreux en Fe ferrique, donc en
inhibant la peroxydation des lipides induite par les ions métalliques,
la céruloplasmine participerait à la protection contre les stress
oxydants. Elle serait également un modulateur des inflammations
(Cousins 1985, Strain 1994). En cas d'infection, le Cu agirait
également directement sur le maintien des fonctions immunitaires tant
naturelles qu'acquises (Percival 1998). Même si la plupart des études
portent sur le rat et sont difficilement transposables au porc, il
semble qu'une carence en Cu induise une diminution du nombre de
lymphocytes T. Concernant l'immunité naturelle, la carence en Cu se
manifeste non seulement par une diminution du nombre de neutrophiles,
mais également par la diminution de leur capacité à produire l'ion
superoxyde nécessaire à l'élimination des microorganismes lors du
processus de phagocytose. Cependant, il n'a jamais été établi si les
besoins en Cu nécessaires à l'optimisation de la fonction immunitaire
sont supérieurs à ceux qui permettent celle de la croissance.
Le Cu est impliqué dans de nombreuses autres fonctions puisqu'il est un
constituant, entre autres, de la cytochrome c oxydase, enzyme terminale
de la chaîne respiratoire dans toutes les cellules de mammifères, de la
lysyl oxydase, qui permet la réticulation entre les chaînes peptidiques
qui forment les molécules d'élastine et de collagène et leur confère
leurs qualités d'insolubilité et d'élasticité, de la dopamine-b-monooxygénase,
nécessaire à la production de catécholamines (O'Dell 1981, Prohaska
1990, Cromwell 1997, Underwood et Suttle 1999).
1.2 / Métabolisme et homéostasie
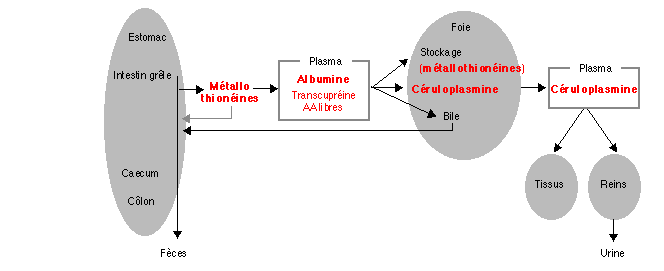
La solubilisation du Cu, comme celle des autres oligo-éléments (Mn, Fe,
Zn) est favorisée par l'acidité gastrique. Dans l'intestin grêle, la
présence de ligands solubles, d'origine alimentaire ou endogène, permet
d'éviter la formation de précipités indisponibles d'hydroxydes due à
l'augmentation du pH (Powell et al
1999). En particulier, les mucines, glycoprotéines sécrétées tout au
long du tube digestif, jouent un rôle prédominant dans l'absorption des
oligo-éléments qui s'y lient et sont ainsi convoyés jusqu'à la muqueuse
où ils sont libérés puis absorbés par les entérocytes. Le Cu est
absorbé par voie active et saturable, au moyen de transporteurs
membranaires (Underwood et Suttle 1999) et le site principal
d'absorption est l'intestin grêle (Bowland et al 1961). Dans le
cytosol des entérocytes, le Cu se lie à des métallothionéines. Ces
protéines ubiquistes peuvent lier jusqu'à 7 atomes de Zn et 12 atomes
de Cu (Bremner 1987). De plus, leur synthèse et leur turn-over seraient
sous l'influence de ces deux oligo-éléments, principalement celle du Zn
(Powell et al 1999). Dans l'intestin, les métallothionéines
joueraient un rôle non seulement dans le transport mais également dans
la séquestration du Cu en cas de surcharge alimentaire (figure 2 ; Bremner 1987, Powell et al
1999). Une fois absorbé, le Cu est transporté vers le foie,
majoritairement par les albumines, mais également par la transcupréine
et les acides aminés libres, notamment l'histidine. Dans le foie, le Cu
est, selon le statut de l'animal, lié aux métallothionéines pour être
stocké, incorporé à la céruloplasmine puis transporté vers d'autres
organes, ou sécrété dans l'intestin grêle via la bile (Bremner 1987,
Buckley 2000).
En cas d'augmentation des apports alimentaires de Cu, la diminution de
l'absorption constitue l'une des voies de maintien de l'homéostasie.
Cependant, l'excrétion endogène et l'accumulation hépatique de Cu en
sont les deux voies majoritaires. Chez le porc, comme chez les autres
monogastriques, l'homéostasie du Cu est en grande partie maintenue par
une augmentation des pertes endogènes de Cu qui évite une accumulation
excessive dans le foie (Underwood et Suttle 1999, Buckley 2000).
L'excrétion biliaire en représente la majorité, les pertes via les
urines, la peau ou les phanères (Buckley 2000) ou via les desquamations
cellulaires dans l'intestin (Powell et al
1999) étant minoritaires. Dans la bile, le Cu est lié à un nombre
important de composés comme des protéines, des sels biliaires, des
peptides et des acides aminés. La faible réabsorption de cette fraction
(Buckley 2000) contribue à l'efficacité du maintien de l'homéostasie
via la sécrétion biliaire.
1.3 /Carence et toxicité
a / Carence
Les cas de carence en Cu chez le porc sont très rarement décrits.
Néanmoins, chez le porcelet nourri à base de lait de vache, carencé en
Cu, Lee et al
(1968) ont observé le développement d'une anémie de type ferriprive. De
même, un aliment contenant environ 100 ppm de Fe, 130 ppm de Zn et 2
ppm de Cu aboutit à des signes d'anémie et des retards de croissance au
bout de 5 semaines chez le porcelet sevré (Gipp et al 1973b).
Hypochrome et microcytaire, cette anémie est liée à une diminution du
nombre de globules rouges, de leur volume et de leur teneur en
hémoglobine et se manifeste par une diminution des teneurs en
hémoglobine et en Fe du sang ainsi que de l'hématocrite. Elle serait
due à une moindre absorption intestinale de Fe, à une moindre activité
de la céruloplasmine ou encore à une modification du métabolisme
intracellulaire du Fe dans le foie (Underwood et Suttle 1999). Bien que
plus rarement évaluée chez le porc, la détérioration de l'activité de
la superoxyde dismutase à Cu et Zn dans les érythrocytes ou dans les
cellules hépatiques apparaît avant les signes d'anémie (Delves 1985).
Okonkwo et al
(1979) indiquent que, distribué pendant 8 semaines consécutives, un
aliment semi-synthétique contenant 5,6 ppm de Cu, dans lequel sont
ajoutés 87 ppm de Zn et 125 ppm de Fe, permet de maintenir la vitesse
de croissance, le bilan en Cu, ainsi que l'activité de la
céruloplasmine plasmatique et de la superoxyde dismutase à Cu et Zn
érythrocytaire de porcelets sevrés à une semaine. Selon le NRC (1998),
dont les recommandations reposent en grande partie sur cette étude, des
aliments contenant 6 ppm et 3,5 ppm de Cu sous forme de sulfate
suffisent à couvrir les besoins respectivement du porcelet en
post-sevrage et du porc en engraissement de plus de 50 kg. Avec la
plupart des matières premières utilisées dans l'alimentation du porc,
cet apport peut théoriquement être satisfait sans supplémentation.
Toutefois, chez des porcelets sevrés ayant reçu pendant 9 semaines des
aliments à base de maïs et de tourteau de soja contenant 100 ppm de Fe,
Hedges et Kornegay (1973) ont observé de moindres teneurs hépatique et
rénale en Fe lorsque l'aliment contenait 7 ppm de Cu comparé à 25. De
plus, chez le porc abattu à 100 kg, le taux d'oxydation des lipides
dans un muscle oxydatif (Psoas major) serait réduit par l'addition de 35 ppm de Cu dans un aliment de base en contenant 14 (Lauridsen et al
1999b). Ainsi, dans l'hypothèse d'une réduction réglementaire des
concentrations de Cu dans l'alimentation du porc, l'absence d'anémie et
le maintien du statut anti-oxydant de l'animal mériteraient d'être
vérifiés, en relation avec le niveau d'apport des autres oligo-éléments
et/ou la nature des matières premières utilisées.
b / Toxicité
Lorsque la capacité d'excrétion du Cu via la bile est dépassée, le Cu
alimentaire en excès est stocké dans le foie (Underwood et Suttle
1999). Aucun signe clinique n'est alors détecté. Lorsque les capacités
de stockage du foie sont dépassées, le Cu est relargué dans la
circulation, conduisant à une phase dite hémolytique qui apparaît
soudainement et se manifeste par des retards de croissance, une
hémoglobinurie et se termine par une jaunisse précédant la mort (Suttle
et Underwood 1999). Chez les ruminants, en particulier les ovins, le
maintien de l'homéostasie via la sécrétion biliaire de Cu est beaucoup
moins efficace que chez les monogastriques et la teneur en Cu du foie
augmente très rapidement avec l'apport alimentaire de Cu (Underwood et
Suttle 1999, Buckley 2000). Ainsi, chez les ovins, des apports
alimentaires relativement faibles, de l'ordre de 15 mg/kg d'aliment,
conduisent à la mort précédée de la phase hémolytique qui apparaît
lorsque la teneur en Cu du foie excède 350 à 1000 ppm MS (Bremner 1998,
Underwood et Suttle 1999). Mais les cas d'empoisonnement fatals sont
extrêmement rares chez le porc. Ainsi, équilibré à 100 ppm de Zn, un
aliment contenant 500 ppm de Cu distribué pendant 5 à 6 semaines à des
porcelets sevrés (Roof et Mahan 1982, Cromwell et al 1989) ou pendant toute la période d'engraissement (Kline et al
1972) ne conduit à aucun phénomène de morbidité ou de mortalité, en
dépit d'une vitesse de croissance légèrement détériorée et des teneurs
hépatiques en Cu pouvant atteindre 1000 à 1500 ppm par rapport à la MS.
La tolérance du porc à des apports excessifs de Cu est liée à sa forme
de stockage hépatique. Majoritairement lié aux métallothionéines, le Cu
ne catalyse pas la formation de radicaux libres, responsables de
l'endommagement des membranes cellulaires. Cependant, une carence en
Zn, en limitant la synthèse de métallothionéines, et donc leur liaison
au Cu, conduirait à l'expression de phénomènes de cytotoxicité (Bremner
1998). La tolérance du porc à des apports importants de Cu est donc
intimement liée à l'apport de Zn. Ainsi, nécrose du foie, ulcères
gastriques et lésions rénales sont décrits par Degoey et al
(1971) chez des porcs en engraissement recevant un aliment contenant
500 ppm de Cu non supplémenté en Zn. Ces signes disparaissent avec
l'apport de 100 ppm de Zn dans l'aliment, sans modification de la
teneur en Cu du foie. De même, la distribution d'un aliment contenant
750 ppm de Cu non supplémenté en Zn conduit à des phénomènes de
toxicité qui disparaissent avec l'apport de 500 ppm de Zn, en dépit
d'une teneur en Cu du foie atteignant 3000 ppm MS (Suttle et Mills
1966a).
Toutefois, de tels niveaux d'apport excèdent largement ceux qui sont
appliqués lorsque le Cu est utilisé comme facteur de croissance. Dans
le cas d'un aliment contenant 250 ppm de Cu, la simple couverture des
besoins en Zn, soit moins de 100 ppm, permet de prévenir tout phénomène
de toxicité (DeGoey et al 1971, Suttle et Mills 1966b).
2 / Le cuivre : facteur de croissance
En raison de ses propriétés stimulantes sur la croissance,
l'introduction de 150 à 250 ppm de Cu dans l'alimentation du porc est
pratiquée depuis les années 1950 (Braude 1980). L'effet stimulant de
l'addition de Cu est surtout constaté chez le porcelet en post-sevrage,
il s'amenuise pour les animaux en croissance (Ward et al 1991) et est pratiquement inexistant en période de finition (Bradley et al 1983).
De façon générale, l'introduction de Cu dans l'aliment stimule
l'appétit des animaux. L'amplitude d'amélioration de l'indice de
consommation est généralement inférieure à celle de la vitesse de
croissance (figure 3).
De plus, l'addition de 150 ppm de Cu sous forme de sulfate est aussi
efficace chez le porcelet en post-sevrage que l'addition de 250 ppm.
Enfin, si l'amélioration de la vitesse de croissance du porcelet en
post-sevrage est supérieure à 30% dans certaines études, elle est
parfois non significative. Ni le mode d'action du Cu comme facteur de
croissance, ni l'origine de ces différences ne sont clairement
identifiés.
2.1 / Modes d'action possibles du cuivre comme facteur de croissance
Zhou et al (1994a) ont mis en évidence la
contribution importante de la stimulation de l'appétit dans l'effet
facteur de croissance du Cu. Selon ces auteurs, le Cu favoriserait la
sécrétion du neuropeptide Y, stimulant de l'appétit. Toutefois, ce
mécanisme ne constitue pas la seule composante de l'effet facteur de
croissance du Cu qui s'exprime également chez des animaux rationnés
(Castell et Bowland 1968, Zhou et al 1994a, Mathé et al
2001). L'implication d'autres phénomènes tels que l'amélioration du
statut immunitaire des animaux, le rôle antimicrobien du Cu,
l'amélioration de l'utilisation digestive de certains composants de la
ration ou encore une action systémique du Cu sur la croissance a été
étudiée.
Selon Kornegay et al (1989), l'addition de
200 ppm de Cu dans l'alimentation de porcelets sevrés n'a pas
d'incidence sur leur statut immunitaire. Cependant, cette piste n'a été
que peu explorée. Les propriétés fongicides et bactéricides du Cu sont
fréquemment citées comme étant à l'origine de son effet facteur de
croissance chez le porc (Poulsen 1998). L'addition de Cu à des cultures
cellulaires de bactéries responsables de dysenterie chez le porc inhibe
leur activité hémolytique (Dupont et al 1994), l'introduction de Cu dans la ration de porcelets sevrés modifie le profil de la flore fécale (Bunch et al
1961), enfin, l'effet du Cu comme facteur de croissance est plus
prononcé chez des porcelets conventionnels que chez des porcelets
axéniques (Shurson et al 1990). A cet égard, Stansbury et al
(1990) suggèrent que l'effet facteur de croissance du Cu s'exprimerait
d'autant mieux que le milieu d'élevage serait de qualité sanitaire
médiocre. Cet effet sur la flore intestinale permettrait de diminuer la
concentration des métabolites bactériens toxiques, notamment
l'ammoniac, dans l'intestin (Varel et al 1987, Menten et al 1988), le taux de renouvellement des cellules épithéliales (Radecki et al 1992), l'absorption portale d'ammoniac (Menten et al 1988, Yen et Pond 1993) et conduirait à une diminution de la masse relative du foie et des reins (Pond et al
1988). La moindre demande énergétique des viscères permettrait alors
une épargne favorisant la croissance de l'animal. Dans ce cas, le mode
d'action du Cu s'apparenterait à celui des antibiotiques utilisés à
doses subthérapeutiques (Yen et Nienaber 1993, Yen et Pond 1993).
Toutefois, la masse relative de l'intestin grêle n'est pas réduite chez
des porcelets recevant 283 ppm de Cu pendant 3 semaines (Shurson et al
1990) ou 250 ppm de Cu pendant 8 semaines (Yen et Pond 1993). De plus,
la demande énergétique des organes drainés par la veine porte (tube
digestif, foie, rate) relativement à celle du corps entier n'est pas
modifiée par l'introduction de 250 ppm de Cu dans l'aliment de porcs en
croissance (Yen et Nienaber 1993).
L'effet facteur de croissance du Cu pourrait également avoir pour
origine l'amélioration de la digestibilité ou de l'utilisation
métabolique de certains composants de la ration. In vitro, Kirchgessner et al (1976) ont en effet constaté un effet stimulant du Cu sur l'activité de la pepsine. Toutefois, in vivo,
le Cu alimentaire est sans incidence sur l'activité de la trypsine et
de la chymotrypsine pancréatiques et intestinales du porcelet sevré
(Luo et Dove 1992) ainsi que sur la digestibilité fécale apparente de
l'azote chez le porcelet sevré (Luo et Dove 1992, Roof et Mahan 1982)
ou chez le porc en croissance (Castell et Bowland 1968, Omole et
Bowland 1974a et b). Cependant, Omole et Bowland (1974b) ont observé
une augmentation de la digestibilité de l'énergie consécutive à
l'introduction de 135 à 210 ppm de Cu dans la ration de porcs en
croissance. Plus précisément, 250 ppm de Cu dans la ration de porcelets
en post-sevrage permettent une augmentation de la digestibilité fécale
de la matière grasse pouvant atteindre 7 à 12 points, qui serait liée à
une stimulation de l'activité de la lipase et de la phospholipase A
dans l'intestin grêle (Dove 1995, Luo et Dove 1996). Selon ces auteurs,
l'effet facteur de croissance du Cu ne s'exprimerait qu'en cas de
teneur énergétique suffisante de l'aliment.
Enfin, Zhou et al
(1994b) ont montré l'effet stimulant du Cu sur la croissance du
porcelet sevré par l'injection intraveineuse d'histidinate de Cu,
suggérant un mode d'action systémique, différent de l'effet
antimicrobien dans le tube digestif. Selon ces auteurs, le Cu agirait
directement sur le système de régulation de la croissance. Cette
hypothèse est corroborée par l'amélioration du coefficient de rétention
de l'azote, sans modification de son coefficient de digestibilité
observée par Luo et Dove (1996).
En définitive, le mode d'action du Cu comme facteur de croissance est
vraisemblablement multifactoriel et différent de celui des
antibiotiques ajoutés à doses subthérapeutiques. Même si de nombreuses
pistes ont déjà été explorées, certaines d'entre elles, en particulier
celles qui concernent le statut immunitaire des animaux et l'action
systémique sur la croissance, mériteraient d'être approfondies. En
effet, une meilleure connaissance de ce mode d'action constituerait un
progrès dans le cadre de la mise au point de stratégies alternatives à
l'usage des antibiotiques dans l'alimentation du porc.
2.2 / Conséquences de l'utilisation du cuivre comme facteur de croissance
a / Accumulation de cuivre dans les produits animaux
L'usage de Cu comme facteur de croissance comporte quelques
désavantages, avec en premier lieu son accumulation dans le foie. Cette
accumulation dépend de la concentration dans l'aliment et de la durée
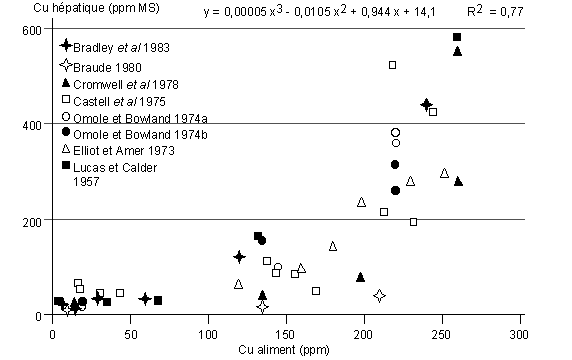
d'exposition (Elliot et Amer 1973). Pour des animaux en engraissement,
l'exposition pendant une durée de 100 à 150 jours entraîne une
augmentation significative de la teneur en Cu dans le foie lorsque
l'aliment en contient plus de 125 ppm (jusqu'à 600 ppm MS, figure 4).
Le Cu s'accumule également dans le rein, mais dans une moindre mesure
(jusqu'à 105 ppm MS). Sa concentration dans le tissu adipeux (1,1 à 3,0
ppm MS), le muscle (1,5 à 5,5 ppm MS) et l'os (2,4 à 2,7 mg/kg) est
faible et indépendante de l'apport alimentaire (e.g. Kline et al 1972, Omole et Bowland 1974 a et b, Castell et al 1975, Bradley et al 1983).
Lorsque l'apport alimentaire de Cu est diminué, la teneur en Cu du foie
diminue rapidement et peut être considérablement abaissée lorsque
l'aliment distribué en fin d'engraissement contient moins de 20 ppm de
Cu. Pour des animaux abattus entre 90 et 100 kg, l'abaissement de
l'apport doit intervenir au plus tard aux alentours de 50 kg lorsque
l'aliment contient 250-260 ppm de Cu (Bunch et al 1963, Elliot et Amer 1973) et aux alentours de 65 kg lorsque l'aliment en contient 135 ppm (Castell et al
1975). Le délai de retrait de la supplémentation à respecter varie donc
considérablement selon la teneur en Cu de l'aliment distribué en début
d'engraissement. Sur la base de ces données, on peut estimer que
l'apport de 175 ppm de Cu jusqu'à la fin de la période de croissance
(60 kg), suivi d'un apport de 20 ppm jusqu'à l'abattage conduit
probablement à des teneurs en Cu hépatique proches de celles qu'on
obtiendrait en limitant les apports à 20 ppm pendant toute la durée
d'engraissement.
Ces données nous permettent d'estimer l'impact de l'apport de Cu dans
l'alimentation du porc sur l'apport quotidien de Cu par les produits
animaux (muscle, foie, rein et gras) dans l'alimentation de l'Homme (tableau 1).
Nous avons envisagé trois scénarios d'apport alimentaire de Cu au porc
correspondant aux réglementations européennes en vigueur (directive
70/524/EEC) (B) ou envisagée (A). Le scénario C nous permet de simuler
l'effet du maintien du Cu comme facteur de croissance en post-sevrage,
comme l'autorise la législation actuelle, suivi de l'abaissement de la
teneur en Cu des aliments d'engraissement à 35 ppm, comme le prévoit le
projet de nouvelle législation. Suivant les apports alimentaires,
seules les teneurs en Cu du foie et des reins varient, les teneurs en
Cu du gras et des muscles en étant indépendantes. L'usage du Cu comme
facteur de croissance pendant le post-sevrage est sans incidence sur la
teneur en Cu des produits si la teneur en Cu de l'aliment du porc est
abaissée pendant la période d'engraissement. Si les apports sont
maintenus à 100 ppm jusqu'à l'abattage, l'estimation de la consommation
quotidienne de Cu par l'Homme est supérieure à celle de ses besoins
(3,6 vs 2 à 3 mg/j). Cette estimation est toutefois à nuancer
puisque le Cu présent dans le foie de porc, probablement en raison de
sa liaison aux métallothionéines, est très peu disponible chez le
poulet (Aoyagi et al 1995) et probablement chez l'Homme.
b / Conséquences sur le métabolisme du fer
Le porc recevant 250 ppm de Cu alimentaire peut présenter des signes d'anémie (Gipp et al
1973, Hedges et Kornegay 1973, Dove et Haydon 1991) de même type que
dans le cas de la carence en Cu. Cependant, son origine est différente
puisqu'elle est due à l'interaction négative qu'exerce le Cu sur le Fe
alimentaire en limitant son absorption (Gipp et al 1973).
L'apparition de signes d'anémie est indépendante de l'efficacité du Cu
sur les performances de croissance des animaux et s'accompagne d'une
diminution des réserves hépatiques et rénales en Fe (Gipp et al
1973, Hedges et Kornegay 1973, Dove et Haydon 1991). Un apport
supplémentaire de Fe par rapport aux 100 ppm habituellement recommandés
pour un animal en post-sevrage (INRA 1989, NRC 1998) permet de prévenir
l'anémie. Pour un aliment contenant 250 ppm de Cu, un apport en Fe de
l'ordre de 200 à 300 ppm semble adéquat (Hedges et Kornegay 1973, Dove
et Haydon 1991).
c / Conséquences sur la qualité du tissu adipeux
L'introduction de 125 à 250 ppm de Cu dans l'aliment tout au long de la
période d'engraissement conduit à la production de gras mous (Amer et
Elliot 1973a, Astrup et Matre 1987), indépendamment de l'effet sur la
croissance (Amer et Elliot 1973b, Astrup et Matre 1987). Cet effet,
observé uniquement dans les dépôts de couverture et non dans le gras
intramusculaire (Lauridsen et al
1999b), résulte de la diminution de la proportion des deux principaux
acides gras saturés (stéarique et palmitique) et de l'augmentation
concomitante de celle d'acides gras monoinsaturés, oléique et
palmitoléique. Le mode d'action du Cu sur le métabolisme des lipides
n'est pas clairement élucidé (Lauridsen et al 1999a et b).
Seuls Ho et Elliot (1974) émettent l'hypothèse selon laquelle
l'activité de désaturation des acides gras dans le foie et le tissu
adipeux seraient augmentée par l'addition de Cu dans la ration.
Cependant, d'un point de vue pratique, l'effet du Cu utilisé comme
facteur de croissance sur le degré d'insaturation des lipides est
limité. D'une part, il est moins prononcé que celui de l'addition de
sources de lipides riches en acides gras monoinsaturés comme l'huile de
colza (Lauridsen et al 1999b). D'autre part, l'interruption de
l'apport de Cu à doses élevées à 70 kg permet de rétablir une qualité
des dépôts adipeux à 92 kg équivalente à celle d'animaux ayant reçu un
aliment additionné de 10 ppm de Cu pendant toute la période
d'engraissement (Amer et Elliot 1973a et b).
d / Stabilité de l'aliment et statut antioxydant de l'animal
Le Cu à l'état ionique favorise l'induction et la propagation de la
peroxydation des lipides (Strain 1994). Par conséquent, l'introduction
de doses élevées de Cu sous forme de sulfate dans l'aliment requiert
quelques précautions quant à l'apport de vitamine E, agent
antiradicalaire extrêmement sensible à l'oxydation. En effet,
l'addition de 250 ppm de Cu sous forme de sulfate dans l'aliment
conduit à une accélération de la destruction des tocophérols
naturellement présents dans les matières premières (Dove et Ewan 1990),
ainsi que, bien que dans de moindres proportions, de celle de l'acétate
dl-a-tocophérol ajouté (Dove et Ewan 1991).
Au contraire, le Cu présent dans l'organisme, en tant que composant
d'enzymes telles que la superoxyde dismutase et la céruloplasmine, agit
comme agent antioxydant. Ainsi, l'addition de 175 ppm de Cu sous forme
de sulfate pendant toute la période d'engraissement entraîne une légère
diminution de la susceptibilité des lipides à l'oxydation dans le
plasma, dans un muscle rouge oxydatif (Psoas major) et dans le foie de porcs abattus à 100 kg (Lauridsen et al
1999a et b). Dans cette étude, une modification de certains composants
enzymatiques et non enzymatiques du système de défense contre les
radicaux libres dans le muscle a été mise en évidence. Notamment
l'activité de la superoxyde dismutase à Cu et Zn et la teneur en
vitamine E ont été augmentées.
3 / Biodisponibilité du cuivre : interactions avec les constituants de la ration
Les événements qui modifient l'utilisation des oligo-éléments ou la
réponse métabolique à leur carence ou leur toxicité peuvent se produire
avant et durant le processus d'absorption ou, de façon systémique, lors
de leur utilisation métabolique dans les tissus. Une composante
importante des interactions se situe probablement avant l'absorption et
consisterait en la formation de composés insolubles, souvent par
complexation des ions métalliques avec des composants alimentaires ou
endogènes, dans l'aliment ou dans le tube digestif. Ces associations
peuvent être modifiées substantiellement durant la digestion, notamment
avec le changement de pH de l'estomac à l'intestin, ce qui rend
malaisée l'étude de leur impact sur la biodisponibilité. Les
interactions négatives n'ont d'importance pratique que si elles
entraînent une augmentation significative des besoins. Néanmoins, une
compréhension insuffisante voire l'ignorance de ces interactions obère
notre capacité à définir de façon adéquate les besoins de l'animal.
Les valeurs de digestibilité apparente relevées dans la littérature sont extrêmement variables, de -12 % (Larsen et al 1999) à 52 % (Adeola et al
1995). Une grande part de cette variabilité peut sans doute être
imputée aux difficultés méthodologiques liées à l'établissement du
bilan métabolique de composants représentant moins de 0,003 % de la
ration et, de surcroît, excrétés à près de 80-90 % (Underwood 1977).
Dans cette configuration, une erreur de 10 % sur l'estimation de la
quantité de Cu excrétée entraîne une variation de la digestibilité
apparente d'environ 8 à 9 points. Au-delà de ces problèmes strictement
analytiques, le statut en Cu des animaux au début de l'expérimentation
ainsi que la durée d'exposition des animaux à un apport donné de Cu
alimentaire avant l'établissement du bilan expliquent vraisemblablement
une partie de cette variabilité (Newton et al 1983). En effet,
lors d'un changement alimentaire, l'organisme atteint un nouvel état
d'équilibre correspondant à l'égalité des apports et des pertes
quotidiens de Cu (Mertz 1987). Or, la stabilisation des réserves
corporelles et des pertes endogènes de Cu peut durer plusieurs semaines
(Mertz 1987, Buckley 2000) et largement excéder le temps habituellement
imparti pour l'établissement d'un bilan métabolique. Toutefois, une
part de cette variabilité peut être la conséquence d'interactions
alimentaires.
3.1 / Interactions avec les autres minéraux
a / Zinc
Le Zn est connu pour son effet antagoniste sur le Cu. Cet effet
s'exercerait par l'induction de la synthèse de métallothionéines qui
séquestrent le Cu dans l'entérocyte, empêchant son transfert vers la
séreuse (Solomons 1983, O'Dell 1989).
Lorsque le Cu est apporté à plus de 200 ppm dans l'aliment,
l'augmentation de la supplémentation en Zn de 50 à 250 ppm (Omole et
Bowland 1974b), 0 à 100 ppm (Bekaert et al 1967) ou de 100 à 300 ppm (Kline et al
1972) n'a que peu ou pas d'effet limitant sur l'accumulation de Cu dans
le foie. De plus, utilisé comme facteur de croissance sous forme de ZnO
à des taux atteignant 3000 ppm, le Zn n'altère pas l'effet facteur de
croissance du Cu (Smith et al 1997).
Avec des apports alimentaires de Cu beaucoup plus modestes, on observe
une altération de la disponibilité du Cu chez l'Homme lorsque le
rapport Zn:Cu excède 10:1 (Solomons 1983). Chez le porcelet sevré à 11
jours, l'apport de 3000 ppm de Zn au lieu de 100 dans un aliment
additionné de 10 ppm de Cu sous forme de sulfate conduit, au bout de 28
jours, à une détérioration du statut en Cu qui se manifeste par une
diminution de la cuprémie, une concentration accrue des
métallothionéines dans le foie et l'intestin ainsi qu'une diminution de
l'activité de la superoxyde dismutase dans les érythrocytes et le foie
(Carlson et al 1999). De même, Hill et al
(1983a) ont induit une carence en Cu chez des porcelets issus de truies
recevant un aliment contenant 5000 ppm de Zn. Ces animaux, sevrés entre
3 et 5 jours, présentaient, au bout de 5 semaines, des signes d'anémie,
une moindre activité de la lysyl oxydase dans l'aorte et de la
cytochrome c oxydase dans le cœur et le foie, si leur alimentation
contenait seulement 4,9 ppm de Cu.
Mathé et al
(2001) ont observé des performances de croissance normales et n'ont pas
enregistré de signes d'anémie chez des porcs en croissance recevant des
aliments contenant 15 ppm de Cu, dont 5 ajoutés sous forme de sulfate,
et 77 ppm de Zn, dont 45 ajoutés sous forme d'oxyde. Toutefois,
certains résultats suggèrent un effet négatif de l'introduction de Zn à
des niveaux proches du besoin dans des aliments contenant de faibles
quantités de Cu. A cet égard, Hill et al (1983b) notent que les
réserves hépatiques en Cu de porcelets issus de truies ayant reçu un
aliment sans Cu et sans Zn ajouté sont plus élevées que celles de
truies recevant une supplémentation de 50 ppm de Zn sous forme d'oxyde.
Cheng et al (1998) observent, chez des porcelets sevrés, une
diminution de la teneur en Cu du foie mais une augmentation de la
teneur en Cu des reins avec l'introduction de 100 ppm de Zn dans un
aliment contenant 15 ppm de Cu et 27 ppm de Zn. Chez des animaux de 95
kg ayant reçu pendant 132 jours une alimentation à base de maïs et de
tourteau de soja additionnée de 10 ppm de Cu, la cuprémie est diminuée
lorsque 15 ppm de Zn sont ajoutés aux 27 ppm que contiennent les
matières premières constitutives du régime (Hill et al 1986). Enfin, Adeola et al (1995) observent une diminution de la digestibilité fécale apparente du Cu (13 vs
21 %) avec l'addition de 100 ppm de Zn sous forme de sulfate dans un
aliment contenant 27 ppm de Zn et 14 ppm de Cu, dont 10 ajoutés sous
forme de sulfate, mais aucun effet sur la cuprémie. Ces résultats,
parfois contradictoires, ne permettent pas de statuer définitivement
sur l'effet du Zn sur la disponibilité du Cu à de tels niveaux
d'incorporation. En particulier, pour ce qui concerne la mesure de la
digestibilité fécale apparente, la probable accumulation de Cu dans la
paroi intestinale et la possible diminution des pertes endogènes de Cu
via la bile lors d'apports accrus de Zn alimentaire (Yu et Beynen 1994)
s'ajoutent aux difficultés d'interprétation évoquées précédemment. Il
serait nécessaire, pour bien cerner l'effet du Zn sur des aliments peu
pourvus en Cu, de choisir les critères les plus sensibles à la carence
en Cu tels que l'activité de la superoxyde dismutase à Cu et Zn dans
les érythrocytes ou le foie (Delves 1985).
b / Soufre et calcium
Lorsque la ration de porcs contient 250 ppm de Cu sous forme de sulfure, l'addition de 500 ppm de sulfure de sodium (Cromwell et al 1978) ou de sulfure ferreux (Prince et al 1979, Ribeiro de Lima et al
1981) conduit à une diminution de l'accumulation de Cu dans le foie.
Selon ces auteurs, le soufre présent dans le tube digestif conduirait,
en milieu anaérobie, à la formation de CuS, insoluble, donc peu
absorbable.
De la même manière, en raison de l'augmentation du pH qu'il occasionne
dans le tube digestif, le calcium pourrait entraîner la précipitation
du Cu sous la forme indisponible d'hydroxydes insolubles. Toutefois, ce
phénomène, observé chez le ruminant, ne semble pas se produire chez le
porc (Kirchgessner et Grassman 1970).
Selon un autre mécanisme, l'augmentation de l'apport alimentaire de Ca
pourrait, au contraire, induire une amélioration de la biodisponibilité
du Cu en diminuant celle du Zn (Pond et al 1975). Cette hypothèse n'a cependant pas été vérifiée de façon probante. Prince et al
(1984) n'ont obtenu qu'une très légère augmentation de l'accumulation
hépatique de Cu chez le porc en croissance en augmentant la teneur en
Ca de 0,65 à 1,2 % dans un aliment contenant 250 ppm de Cu. De même,
l'augmentation de la teneur en Ca de 0,32 à 1,1 % MS dans un aliment
riche en phytates, sans Cu ni Zn ajoutés (la MS contenant 3,5 ppm de Cu
et 26 ppm de Zn) n'a pas modifié les bilans de Cu et de Zn chez des
porcs de 35 kg (Larsen et Sandström 1993). Dans cette étude, l'absence
d'effet du Ca sur le bilan de Zn rend toutefois difficile
l'interprétation du bilan de Cu. Des études complémentaires, utilisant
de meilleurs indicateurs du statut en Cu et visant à une meilleure
compréhension et surtout une meilleure quantification de l'effet
négatif du Zn sur la disponibilité du Cu en relation avec l'apport de
Ca mériteraient d'être entreprises.
3.2 / Interactions avec les composants organiques de la ration
a / Phytates
L'acide phytique représente la forme majeure de stockage du phosphore
dans les céréales, les légumineuses et les oléagineux. Son effet
antinutritionnel est dû aux six groupes phosphate capables de se lier
avec des cations di- et trivalents pour former des complexes stables,
appelés phytates. L'effet négatif de la présence de phytates, dans
l'aliment ou dans l'intestin, sur la disponibilité du Zn est reconnu.
Son effet sur la biodisponibilité du Cu est plus controversé (Kratzer
et Vohra 1986, Pallauf et Rimbach 1997). Comparé au Zn, le Cu serait
moins sensible à la présence de phytates de Ca dans le tube digestif en
raison de sa plus grande affinité pour d'autres chélatants, notamment
les acides aminés libres (Wise et Gilburt 1982), capables de préserver
sa solubilité (Mills 1985).
Toutefois, certains résultats suggèrent qu'en cas d'apports modérés de
Cu (<15 ppm dans l'aliment), les phytates peuvent conduire à une
réduction de la biodisponibilité du Cu, d'autant plus prononcée que
l'apport en Zn est faible. Ainsi, chez le porcelet sevré et le porc en
croissance, l'addition de 500 à 1500 unités de phytase microbienne dans
des aliments modérément supplémentés en Cu (<14 ppm) et en Zn
(<60 ppm) conduit à une amélioration de 7 à 31 points de la
digestibilité fécale apparente du Cu (Pallauf et al 1992, Adeola et al 1995, Gebert et al 1999). Au contraire, selon Adeola et al
(1995), lorsque l'aliment contient 126 ppm de Zn, la digestibilité
fécale apparente du Cu devient indépendante de l'activité phytasique.
Adeola (1995) obtient toutefois une amélioration de 8 points de la
digestibilité fécale apparente du Cu par l'addition de 1500 unités de
phytase microbienne dans un aliment contenant 5 ppm de Cu et 106 ppm de
Zn.
En cas d'apports supérieurs en Cu, de l'ordre de 120 à 150 ppm, une
amélioration significative de la digestibilité fécale apparente du Cu
par l'addition de 500 à 1500 unités de phytase microbienne a été
observée (Kirchgessner et al
1994, Adeola 1995). Elle n'est toutefois pas constatée lorsque 500
unités de phytase microbienne sont ajoutées dans un aliment contenant
60 ppm de Cu (Adeola 1995).
En tout état de cause, l'impact de l'incorporation de phytase
microbienne dans l'aliment du porc sur la disponibilité du Cu devrait
être vérifié en distinguant son éventuel effet direct sur le Cu de
celui, indirect et négatif, qu'elle pourrait exercer en améliorant la
disponibilité du Zn.
b / Matière grasse
Chez le porcelet sevré, Dove (1995) observe un bilan de Cu négatif (-1,5 vs
0,8 mg Cu retenu/j) lorsque 5 % de matière grasse animale sont ajoutés
à un aliment à base de maïs et de tourteau de soja supplémenté avec 15
ppm de Cu sous forme de sulfate. Selon cet auteur, la présence de
matière grasse dans le régime entraînerait la formation de savons dans
le tube digestif à l'origine de la diminution de la disponibilité du Cu
et d'autres oligo-éléments tels que le Zn et le Fe. Au contraire, Luo
et Dove (1996), avec les mêmes types d'aliment et d'animaux, n'ont
relevé aucun effet de la présence de graisse animale dans l'aliment sur
la cuprémie ou la concentration hépatique de Cu. Enfin, l'addition de 6
% d'huile de colza dans un aliment à base de céréales et de tourteau de
soja, contenant 15 ppm de Cu entraîne une augmentation de la teneur en
Cu hépatique chez le porc en engraissement abattu à 100 kg (Lauridsen et al
1999a). L'effet négatif de la présence de quantités importantes de
matières grasses dans l'aliment sur la disponibilité du Cu n'est donc
pas établi, de même que l'impact du type de matière grasse n'est pas
élucidé.
c / Fibres
Bien que leur effet soit difficile à distinguer de celui des phytates,
les fibres pourraient également constituer des chélatants des
oligo-éléments, les rendant moins disponibles. Chez l'Homme, les
pectines seraient sans effet sur la rétention de Cu alors que
l'addition de cellulose entraînerait une diminution de la digestibilité
apparente du Cu (Kies et Umoren 1989). Chez le porc en croissance, des
taux élevés de fibres riches en hémicellulose ou en lignocellulose ne
modifient pas de façon notable le bilan en oligo-éléments sur le long
terme (Moore et Kornegay 1987). En effet, un impact négatif de
l'addition de 10 % de son d'avoine (Moore et al 1986) ou de 10 % ou 20 % de son de blé (Moore et al 1983, Newton et al
1983) sur la digestibilité fécale apparente du Cu n'est détecté que
pour des durées de bilan inférieures à 15 jours. Pour des durées de
bilan supérieures à 20 jours, la rétention de Cu n'est pas modifiée par
l'addition de 15 % de son d'avoine, de 15 % de coque de soja ou de 20 %
de farine de luzerne dans un aliment pour porcelets sevrés (Moore et al 1988) et de 50 % d'avoine (Ravindran et al 1984) ou de 10 à 20 % de son de blé (Newton et al 1983) dans un aliment pour porcs charcutiers.
D'autres éléments organiques comme certains tanins, ligands potentiels
pour le Cu, sont susceptibles d'en modifier la disponibilité (Kies et
Umoren 1989).
4 / Sources d'apport de cuivre dans l'alimentation du porc
La teneur en Cu des céréales, de leurs co-produits et des graines
d'oléoprotéagineux se situe aux environs de 5 à 15 ppm. Les tourteaux
d'oléagineux sont légèrement plus riches, avec des teneurs atteignant
20 ppm pour les tourteaux de soja. Les farines de viande, désormais
interdites, présentent les teneurs les plus élevées, pouvant atteindre
100 ppm, tandis que les produits laitiers en sont quasiment dépourvus
(INRA 1989, NRC 1998, CVB 2000). La biodisponibilité du Cu dans les
matières premières a été peu étudiée chez le porc. A notre
connaissance, seuls Larsen et Sansdtröm (1993) indiquent que 29 % du Cu
présent dans un tourteau de colza est retenu par le porc en croissance.
Le plus souvent, les aliments pour animaux sont supplémentés en sulfate
de Cu. D'autres sources de supplémentation, minérales ou organiques,
sont parfois utilisées. Leur intérêt par rapport au sulfate de Cu a été
évalué en comparant, souvent à des niveaux d'apport élevés, l'effet sur
les performances de croissance (tableaux 2 et 3).
Certains auteurs ont par ailleurs estimé leur biodiponibilité en
mesurant l'accumulation hépatique de Cu. Plus rarement, le bilan de Cu
a été calculé.
4.1 / Sources minérales
L'utilisation du sulfure (CuS) a été abandonnée compte tenu de son
insolubilité, de sa faible absorption intestinale et de son
inefficacité comme facteur de croissance (Bowland et al 1961, Cromwell et al
1978). Selon les études, l'oxyde de Cu (CuO) est considéré comme un
facteur de croissance aussi efficace que le sulfate de Cu (Bunch et al 1961, Bekaert et al 1967) ou comme dépourvu d'effet sur la croissance des animaux (Cromwell et al 1989). Ces différences sont attribuées au mode d'obtention des oxydes et à leur solubilité (Cromwell et al
1989). Cependant, l'usage de CuO n'entraîne jamais d'accumulation de Cu
dans le foie, ce qui suggère une faible disponibilité par rapport aux
sulfates (Bunch et al 1961, Cromwell et al 1989). La forme carbonate (CuCO3) présente des propriétés de facteur de croissance, entraîne une accumulation hépatique de Cu (Bunch et al 1965) et induit un bilan de Cu (Buescher et al 1961) équivalents à ceux du sulfate de Cu (tableau 2).
4.2 / Sources organiques
D'autres sources d'oligo-éléments, dites protégées, résultent de la
complexation d'un métal par une molécule organique. La molécule peut
être une protéine partiellement hydrolysée (protéinate de métal), un
acide aminé (complexe métal-acide aminé) ou encore des polysaccharides
(complexe métal polysaccharides). Un chélate est un complexe
particulier pour lequel le métal est attaché au ligand en au moins deux
points (Kratzer et Vohra 1986). La chélation ou la complexation
permettraient d'améliorer la biodisponibilité du métal en le protégeant
contre des agents complexants insolubles ou des antagonistes présents
dans le tube digestif (Kirchgessner et Grassman 1970) et/ou en
favorisant son absorption ou son utilisation métabolique. Toutefois,
aucun de ces mécanismes n'a été clairement mis en évidence
expérimentalement (Beutler et al 1998).
L'examen des données disponibles dans la littérature ne permet pas de
conclure sur les avantages des sources organiques par rapport au
sulfate (tableau 3). Selon Coffey et al
(1994), un complexe Cu-Lys est supérieur au sulfate parce qu'il permet
de stimuler la croissance des animaux en évitant l'accumulation de Cu
dans le foie, tandis que selon Apgar et al (1995), il présente
une meilleure biodisponibilité en raison d'une accumulation hépatique
plus élevée. Par ailleurs, les niveaux d'incorporation utilisés dans la
plupart des études entreprises jusqu'à présent ne correspondent pas au
contexte actuel de réduction des apports de Cu. De plus, les critères
utilisés, y compris l'accumulation de Cu dans le foie, sont
vraisemblablement trop imprécis pour permettre de conclure
définitivement sur ce sujet. L'étude plus approfondie de la protection
permise par la complexation et l'évaluation de l'intégrité de certaines
fonctions physiologiques auxquelles participe le Cu devraient permettre
de compléter le travail déjà effectué et de statuer de façon plus sûre
sur les avantages que procure l'utilisation de ces produits.
5 / Cuivre et environnement
Selon certains auteurs, l'introduction de 250 ppm de Cu dans
l'alimentation du porc peut avoir un effet bénéfique sur
l'environnement. Ainsi, en influant sur la population microbienne
intestinale, elle induirait une modification des fermentations
permettant de diminuer l'intensité et d'améliorer la qualité de l'odeur
de lisier de porc (Armstrong et al
2000b). En dépit de cet effet bénéfique, l'impact négatif de
l'incorporation massive de Cu dans l'alimentation du porc demeure la
principale préoccupation.
Compte tenu de la faible valeur du coefficient de rétention du Cu, la
réglementation actuelle (directive 70/524/EEC), qui autorise un apport
alimentaire de Cu largement au-dessus des besoins, notamment en
engraissement, conduit à la production de lisiers très riches en cet
élément. Des teneurs de l'ordre de 700 à 800 ppm MS sont mesurées dans
des lisiers de porcs en engraissement recevant un aliment contenant
environ 100 ppm de Cu (Héduit et al
1977, Priem et Maton 1980, Levasseur et Texier 2001). L'utilisation de
tels produits comme fertilisants n'est pas sans conséquence sur
l'environnement.
5.1 / Conséquences environnementales de l'épandage de lisier de porc riche en Cu
Le Cu apporté lors de l'épandage de déjections animales s'accumule dans
la couche arable (McGrath 1980, Arzul et Maguer 1990) et seuls 2 à 10 %
du Cu apporté sont exportés par les eaux de drainage et les cultures
(McGrath 1980). Ainsi, un enrichissement progressif de sols
régulièrement fertilisés au moyen de lisier de porc pouvant atteindre
0,37 ppm par an entre 1973 et 1988 a été mis en évidence dans certaines
régions du Finistère (Coppenet et al 1993). Cette accumulation a des conséquences non négligeables.
a / Transfert vers la plante
Dans un sol, seule la fraction du Cu capable d'échanges avec les ions
en solution est phytodisponible. L'intensité de ces échanges dépend du
pH du sol, de son potentiel d'oxydoréduction et de sa texture (Morel
1997). Les parties aériennes, donc consommées, des céréales,
oléagineux, protéagineux et fourrages ne s'enrichissent pas en Cu
lorsque la teneur en Cu du sol sur lequel elles sont cultivées augmente
(Hartmans 1978, McGrath 1980). La contamination de la chaîne
alimentaire par cette voie est donc un problème secondaire par rapport
au risque de phytotoxicité, qui se manifeste par une diminution des
rendements par hectare, proportionnelle à l'enrichissement en Cu du
sol. Les espèces les plus sensibles sont les légumineuses, suivies des
céréales à paille puis des prairies (Hartmans 1978, McGrath 1980).
Coppenet et al
(1993), sur des sols granitiques bretons, estiment que des
phytotoxicités irréversibles sont à craindre pour des teneurs
atteignant 120 ppm, soit à échéance de 100 ans si la quantité de Cu
appliqué dans certaines régions d'élevage intensif n'est pas abaissée.
b / Transfert vers le réseau hydrographique
Alimentés par l'érosion des éléments non solubles, les sédiments
prélevés à proximité de parcelles fertilisées au moyen de lisier de
porc s'enrichissent également en Cu. Accumulé dans les sédiments des
estuaires, le Cu peut être remobilisé, sous l'effet du changement de
conditions physico-chimiques à l'interface sédiment-eau, et prélevé par
les organismes marins. Il peut contribuer à la contamination de la
chaîne alimentaire. Arzul et Maguer (1990) font une liaison directe
entre le nombre de porcs produits par ha à proximité des côtes et la
teneur en Cu des sédiments prélevés dans les estuaires bretons.
Cependant, sur un petit bassin versant du Finistère, L'Herroux (1997)
n'observe aucune pollution des eaux et des sédiments consécutive aux
apports métalliques liés aux épandages d'effluents d'élevage. Les
transferts d'éléments métalliques vers le réseau hydrographique
seraient régulés au niveau des zones humides de fond de vallées
(Olivié-Lauquet et al 2000).
c / Toxicité envers la microflore du sol
La microflore des sols est très sensible à une augmentation des teneurs
en éléments métalliques et ce pour des concentrations dans les sols
bien inférieures aux seuils de phytotoxicité. Cependant, de fortes
teneurs en matière organique, des teneurs importantes en argile ou un
pH élevé réduisent considérablement la toxicité (McGrath et al
1995). Le temps de séjour des éléments dans le sol est également
important puisque les différentes populations de microorganismes qui
s'y trouvent peuvent s'adapter à des concentrations élevées (Yeates et al 1994).
d / Cas d'empoisonnement de moutons au pâturage
Des cas d'empoisonnement de moutons ayant pâturé des prairies
fertilisées avec du lisier de porc riche en Cu ont été relatés (Poulsen
1998). Cette absorption excessive de Cu est davantage attribuée à
l'ingestion de particules de sol riches en Cu qu'à celle d'un fourrage
contaminé (Hartmans 1978). En fait, le Cu présent dans les déjections
de porc, principalement sous forme de CuS, serait peu disponible pour
le mouton (34 % par rapport à un sulfate) et donc peu toxique.
Cependant, au bout de quelques semaines après l'épandage, le Cu
deviendrait plus disponible, donc plus toxique, en raison de
l'oxydation des sulfures en sulfates (Hartmans 1978). Compte tenu de la
quantité de terre ingérée par les animaux, cet auteur conclut qu'une
parcelle située sur un sol contenant plus de 25-30 ppm de Cu ne doit
pas être pâturée par des moutons.
5.2 / Impact de la réduction du Cu alimentaire sur les rejets de Cu
Paboeuf et al (2000 et 2001) ont montré
expérimentalement que l'abaissement de la supplémentation en Cu de 80 à
10 ppm dans l'aliment des porcs en engraissement permet de réduire de
75 % les rejets de cet élément, sans modifier les performances des
animaux. Réduire les apports de Cu dans l'alimentation des porcs
constitue donc une voie de choix pour en limiter les rejets. Cinq
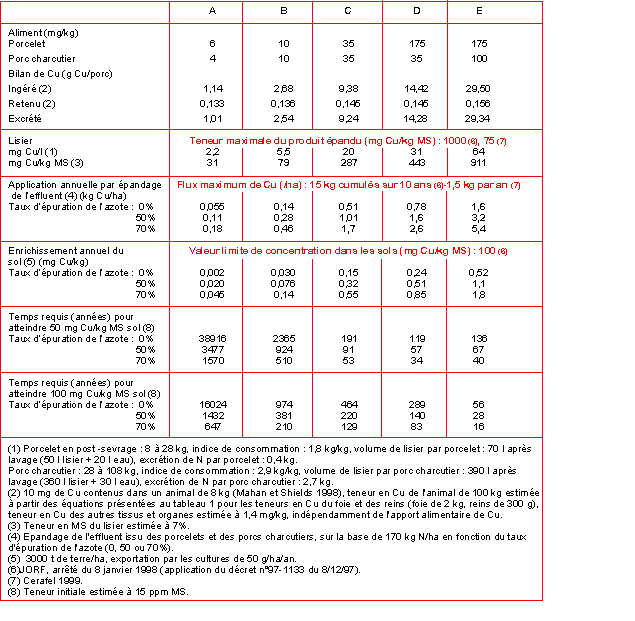
scénarios d'apport alimentaire de Cu ont été envisagés (tableau 4).
Les deux premiers (A et B) correspondent respectivement aux
recommandations du NRC (1998) et à celles de l'INRA (1989). Les
scénarios suivants correspondent aux réglementations européennes en
vigueur (directive 70/524/EEC) (E) ou envisagée (C). Le scénario D, qui
est intermédiaire, nous permet de simuler l'effet du maintien du Cu
comme facteur de croissance en post-sevrage, comme l'autorise la
législation actuelle, suivi de l'abaissement de la teneur en Cu des
aliments d'engraissement à 35 ppm, comme le prévoit le projet de
nouvelle législation.
La quantité de lisier produite par animal ainsi que sa teneur en azote
a été calculée à partir des références fournies par le CORPEN (1996).
Compte tenu de sa faible influence sur l'indice de consommation, on a
supposé que la teneur en Cu des aliments n'avait pas d'effet sur la
quantité de lisier produite. La teneur en Cu des effluents a été
comparée aux teneurs en Cu maximales autorisées d'une part par la
législation portant sur l'utilisation, comme fertilisant, de boues
issues de traitement d'eaux usées (1000 mg/kg MS : JORF 1998) et,
d'autre part, par le cahier des charges pour l'utilisation des matières
organiques fertilisantes dans les zones légumières bretonnes (75 mg/kg
MS : CERAFEL 1999). De plus, la quantité de Cu appliquée par hectare a
été comparée aux maxima stipulés dans chacun de ces deux documents.
Enfin, le temps requis pour atteindre des teneurs en Cu de 50 et 100
ppm MS des sols a été calculé. Au-delà de cette dernière concentration,
tout épandage de boue est proscrit (JORF 1998).
Seul le scénario A, qui correspond à la distribution d'aliments sans
supplémentation en Cu, permet de produire des effluents épandables dans
les zones légumières bretonnes. Pour les autres scénarios, y compris
pour le scénario B qui correspond aux recommandations de l'INRA (1989),
la teneur limite de 75 mg/kg MS est dépassée. En revanche, aucun des
scénarios ne conduit à un lisier présentant une teneur en Cu supérieure
à la limite applicable aux boues issues de traitement d'eaux usées.
Dans les conditions légales actuelles d'apport de Cu dans l'aliment des
porcelets et des porcs en engraissement (scénario E), la prise en
compte de la seule quantité d'azote épandue par hectare peut conduire à
une application excessive de Cu au regard de la limite annuelle de 1,5
kg/ha. La teneur limite de 100 ppm MS de Cu dans les sols pourrait être
atteinte à échéance de 40 ans dans le cas d'un traitement du lisier
permettant de diminuer de 70 % sa teneur en azote.
Comparée à la législation actuelle (scénario E), le projet que propose
la Commission Européenne (scénario C) permettrait une réduction des
rejets de Cu de l'ordre de 70 %. Le maintien de l'usage du Cu comme
facteur de croissance en post-sevrage puis la limitation des apports à
35 ppm en engraissement (scénario D) pourrait constituer un moyen terme
intéressant, puisque les rejets seraient réduits d'environ 50 % par
rapport à la législation actuelle. Toutefois, l'élimination de 50 % de
l'azote contenu dans le lisier conduirait à la production de
fertilisants entraînant une application annuelle de Cu supérieure à 1,5
kg/ha. Enfin, cette option ne résoudrait pas les problèmes des élevages
spécialisés en post-sevrage puisque la teneur en Cu du lisier resterait
supérieure à la limite de 1000 ppm MS applicable aux boues issues du
traitement des eaux usées.
Conclusion
Dans l'alimentation du porc, le Cu a surtout été étudié pour ses
propriétés de facteur de croissance. De nombreux travaux ont permis
d'établir que l'introduction de 150 à 250 ppm de Cu dans l'alimentation
du porc, et en particulier du porcelet en post-sevrage, permet d'en
stimuler la croissance, à condition de respecter un apport en Fe
suffisant pour éviter les risques d'anémie. Cependant, l'innocuité de
telles pratiques d'élevage pour l'alimentation humaine ne peut être
garantie que si elles sont limitées à la période du post-sevrage. De
même, leur impact sur l'environnement est d'autant plus faible que les
apports de Cu pendant l'engraissement sont significativement abaissés.
Toutefois, même dans le cas de la seule utilisation du Cu comme facteur
de croissance en post-sevrage, les conséquences environnementales ne
sont pas négligeables et une réduction drastique des apports demeure
une solution préventive de choix. Les connaissances actuelles ne
permettent cependant pas de l'envisager sans risque sur les
performances ou la santé des animaux. Des progrès sont encore à faire
dans la connaissance des principaux facteurs de variation de la
disponibilité du Cu, en approfondissant l'étude des composants
alimentaires interagissant avec le Cu et en hiérarchisant leur impact.
A cet égard, l'effet de la présence de phytates dans l'aliment, en
relation avec l'apport de Zn, sur la disponibilité du Cu reste à
évaluer. De plus, les solutions d'amélioration de la disponibilité du
Cu, soit par l'utilisation de sources dites protégées soit par
l'utilisation d'additifs susceptibles de modifier l'impact de certains
ligands du Cu restent à évaluer dans des conditions de faibles apports
alimentaires de Cu. De façon concomitante, le choix des indicateurs du
statut en Cu des animaux doit être précisé. Les nutritionnistes font
souvent appel à des méthodes classiques d'évaluation de la
disponibilité, tels que le bilan métabolique, qui aboutissent à des
résultats parfois difficiles à interpréter dans le cas des
oligo-éléments. Les indicateurs de la carence en Cu, tels que ceux du
statut antioxydant ou de l'immunité sont sans doute à privilégier. En
tout état de cause, les futures études doivent aboutir à une meilleure
précision des besoins du porc de façon à émettre les recommandations
d'apport en Cu les plus faibles possibles. Elles seront sans doute à
moduler en fonction de la nature de la ration et de l'apport en
certains antagonistes du Cu.
Remerciements
Les auteurs expriment toute leur gratitude à Louis-Aimé Aumaître pour
les informations qu'il leur a fournies lors de la préparation de ce
manuscrit ainsi que pour le soin qu'il a apporté à sa relecture.
Références
Adeola O., 1995. Digestive utilization of minerals by weanling pigs fed
copper- and phytase-supplemented diets. Can. J. Anim. Sci., 75,
603-610.
Adeola O., Lawrence B.V., Sutton A.L., Cline T.R., 1995.
Phytase-induced changes in mineral utilization in zinc-supplemented
diets for pigs. J. Anim. Sci., 73, 3384-3391.
Amer M.A., Elliot J.I., 1973 a. Effects of level of copper supplement
and removal of supplemental copper from the diet on the physical and
chemical characteristics of porcine depot fat. Can. J. Anim. Sci., 53,
139-145.
Amer M.A., Elliot J.I., 1973 b. Influence of supplemental dietary
copper and vitamin E on the oxidative stability of porcine depot fat.
J. Anim. Sci., 37, 87-90.
Apgar G.A., Kornegay E.T., 1996. Mineral balance of finishing pigs fed
copper sulfate or a copper-lysine complex at growth-stimulating levels.
J. Anim. Sci., 74, 1594-1600.
Apgar G.A., Kornegay E.T., Lindemann M.D., Notter D.R., 1995.
Evaluation of copper sulfate and a copper lysine complex as growth
promoters for weanling swine. J. Anim. Sci., 73, 2640-2646.
Aoyagi S., Hiney K.M., Baker D.H., 1995. Copper bioavailability in pork
liver and in various animal by-products as determined by chick
bioassay. J. Anim. Sci., 73, 799-804.
Armstrong T.A., Spears J.W., van Heugten E., Engle T.E., Wright C.L.,
2000a. Effect of copper source (cupric citrate vs cupric sulfate) and
level on growth performance and copper metabolism in pigs. Asian-Aust.
J. Anim. Sci., 13, 1154-1161.
Armstrong T.A., Williams C.M., Spears J.W., Schiffman S.S., 2000b. High
dietary copper improves odor characteristics of swine waste. J. Anim.
Sci., 78, 859-864.
Arzul G., Maguer J.F., 1990. Influence of pig farming on the copper
content of estuarine sediments in Brittany, France. Marine Pollution
Bull., 21, 91-107.
Astrup H.N., Matre T., 1988. Feed conversion, pork fat softening and
liver malondialdehyde reactivity in pigs supplemented with copper.
Norw. J. Agric. Sci., 1, 81-86.
Bekaert H., Eeckhout W., Buysse F., 1967. L'influence de CuSO4 et de
CuO, ainsi que du degré de granulométrie du CuSO4 et d'un supplément de
zinc sur les résultats d'engraissement et la teneur en cuivre du foie
chez des porcs à l'engrais. Rev. Agric. (Bruxelles), 11-12, 636-05.
Beutler K.T., Pankewicz O., Brautigan D.L., 1998. Equivalent uptake of
organic and inorganic zinc by monkey kidney fibroblasts, human
intestinal cells, or perfused mouse intestine. Biol. Trace Element
Res., 19-31.
Bories G., 1980. The effect on human copper status of the consumption
of edible tissues from animal fed Cu-rich diets. In : P. L'Hermite
and J. Dehandtschutter (eds), Copper in animal wastes and sewage
sludge, Proc. EEC Workshop, INRA Publisher, 8-10 October 1980,
Bordeaux, France, 311-323.
Bowland J.P., Braude R., Chamberlain A.G., Glascock R.F., Mitchell
K.G., 1961. The absorption, distribution and excretion of labelled
copper in young pigs given different quantities, as sulphate or
sulphide, orally or intravenously. Br. J. Nutr., 15, 59-72.
Bradley B.L., Graber G., Condon R.J., Frobish L.T., 1983. Effects of
graded levels of dietary copper on copper and iron concentrations in
swine tissues. J. Anim. Sci., 56, 625-630.
Braude R., 1980. Twenty five years of widespread use of copper as an
additive to diets of growing pigs. In : P. L'Hermite.and J.
Dehandtschutter (eds), Copper in animal wastes and sewage sludge, Proc.
EEC Workshop, INRA Publisher, 8-10 October 1980, Bordeaux, France,
3-15.
Bremner I., 1987. Involvement of metallothionein in the hepatic metabolism of copper. J. Nutr., 117, 19-29.
Bremner I., 1998. Manisfestations of copper excess. Am. J. Clin. Nutr., 67, 1069S-1073S.
Buckley W.T., 2000. Trace elements dynamics. In : Farm Animal
Metabolism and Nutrition. In : J.P.F. D'Mello (eds), CABI
Publishing, Edinburgh, UK, 161-182.
Buescher R.G., Griffin S.A., Bell M.C., 1961. Copper availability to swine from 64Cu labelled inorganic compounds. J. Anim. Sci., 20, 529-531.
Bunch R.J., Speer V.C., Hays V.W., Hawbaker J.H., Catron D.V., 1961.
Effects of copper sulfate, copper oxide and chlorotetracycline on baby
pig performance. J. Anim. Sci., 20, 723-726.
Bunch R.J., Speer V.C., Hays V.W., McCall J.T., 1963. Effects of high
levels of copper and chlortetracycline on performance of pigs. J. Anim.
Sci., 22, 56-60.
Bunch R.J., McCall J.T., Speer V.C., Hays V.W., 1965. Copper supplementation for weanling pigs. J. Anim. Sci., 24, 995-1000.
Carlson M.S., Hill G.M., Link J.E., 1999. Early- and traditionally
weaned nursery pigs benefit from phase-feeding pharmacological
concentrations of zinc oxide: effect on metallothionein and mineral
concentrations. J. Anim. Sci., 77, 1199-1207.
Castell A.G., Bowland J.P., 1968. Supplemental copper for swine growth,
digestibility and carcass measurement. Can. J. Anim. Sci., 48, 403-413.
Castell A.G., Allen R.D., Beames R.M., Bell J.M., Belzile R., Bowland
J.P., Elliot J.I., Ihnat M., Larmond E., Mallard T.M., Spurr D.T.,
Stothers S.C., Wilton S.B., Young L.G., 1975. Copper supplementation of
canadian diets for growing-finishing pigs. Can. J. Anim. Sci., 55,
113-134.
CERAFEL, 1999. Cahier des charges pour l'utilisation des matières
fertilisantes organiques en zones légumières nord Bretagne. Comité
Economique Régional Agricole Fruits et Légumes de Bretagne, Chambres
d'Agriculture de Bretagne, version 1 du 3 juin 1999, 28 pp.
Cheng J., Kornegay E.T., Schell, T.C., 1998. Influence of dietary
lysine on the utilisation of zinc from zinc sulfate and a zinc-lysine
complex by young pigs. J. Anim. Sci., 76, 1064-1074.
Coffey R.D., Cromwell G.L., Monegue H.J., 1994. Efficacy of a
copper-lysine complex as a growth promotant for weanling pigs. J. Anim.
Sci., 72, 2880-2886.
Coppenet M., Golven J., Simon J.C., Le Roy M., 1993. Evolution chimique
des sols en exploitations d'élevage intensif: exemple du Finistère.
Agronomie, 13, 77-83.
CORPEN, 1996. Estimation des rejets d'azote et de phosphore des
élevages de porcs. Impact des modifications de conduite alimentaire et
des performances techniques. Comité d'Orientation pour la Réduction de
la pollution des Eaux par les Nitrates, les phosphates et les produits
phytosanitaires provenant des activités agricoles. République
Française, Ministère de l'Agriculture de la Pêche et de l'Alimentation,
Ministère de l'Environnement, 23 pp.
Cousins R.J., 1985. Absorption, transport and hepatic metabolism of
copper and zinc: special reference to metallothionein and
ceruloplasmin. Physiol. Rev., 65, 238-309.
Cromwell G.L., 1997. Copper as a nutrient for animals. In : H.W.
Richardson (eds), Handbook of copper compounds and applications, Marcel
Dekker Inc. Publisher, New-York, USA, 177-202.
Cromwell G.L., Hays V.W., Clark D.D., 1978. Effects of copper sulfate,
copper sulfide and sodium sulfide on performance and copper stores of
pigs. J. Anim. Sci., 46, 692-698.
Cromwell G.L., Stahly T.S., Monegue H.J., 1989. Effects of source and
level of copper on performance and liver copper stores in weanling
pigs. J. Anim. Sci., 67, 2996-3002.
Cromwell G.L., Lindemann M.D., Monegue H.J., Hall D.D., Orr D.E., Jr.,
1998. Tribasic copper chloride and copper sulfate as copper sources for
weanling pigs. J. Anim. Sci., 76, 118-123.
CVB, 2000. Veevoedertabel. Centraal Veevoederbureau, Lelystad, The Netherlands.
Degoey L.W., Wahlstrom R.C., Emerick R.J., 1971. Studies of high level
copper supplementation to rations for growing swine. J. Anim. Sci., 33,
53-57.
Delves H.T., 1985. Assessment of trace element status. Clinics in Endocrin. and Metab., 14, 725-761.
Dove C.R., 1995. The effect of copper level on nutrient utilization of weanling pigs. J. Anim. Sci., 73, 166-171.
Dove C.R., Ewan R.C., 1990. Effect of excess dietary copper, iron or
zinc on the tocopherol and selenium status of growing pigs. J. Anim.
Sci., 68, 2407-2413.
Dove C.R., Ewan R.C., 1991. Effect of trace minerals on the stability
of vitamin E in swine grower diets. J. Anim. Sci., 69, 1994-2000.
Dove C.R., Haydon K.D., 1991. The effect of copper addition to diets
with various iron levels on the performance and hematology of weanling
swine. J. Anim. Sci., 69, 2013-2019.
Dupont D.P., Duhamel G.E., Carlson M.P., Mathiesen M.R., 1994. Effect
of divalent cations on hemolysin synthesis by Serpulina (Treponema)
hyodysenteriae: inhibition induced by zinc and copper. Vet. Microbiol.,
41, 63-73.
Elliot J.I., Amer M.A., 1973. Influence of level of copper supplement
and removal of supplemental copper from the diet on the performance of
growing-finishing pigs and accumulation of copper in the liver. Can. J.
Anim. Sci., 53, 133-138.
Evans P., Halliwell B., 2001. Micronutrients: oxidant/antioxidant status. Br. J. Nutr., 85, S67-S74.
Favier A., 1991. Les oligo-éléments en nutrition humaine. In P.
Chappuis (Eds), Les oligoéléments en médecine et biologie, SFERETE
Publisher, Paris, France, pp 41-75.
Gebert S., Bee G., Pfirter H.P., Wenk C., 1999. Phytase and vitamin E
in the feed of growing pigs. 1. Influence on growth, mineral
digestibility and fatty acids in digesta. J. Anim. Physiol. a. Anim.
Nutr., 81, 9-19.
Gipp W.F., Tasker J.B., van Campen D., Krook L.P., Visek W.J., 1973.
Influence of level of dietary copper on weight gain, hematology and
liver copper and iron storage of young pigs. J. Nutr., 103, 713-719.
Hartmans J., 1978. Identifying the priority contaminants toxicological
aspects of animal effluents. In : W.R. Kelly (Eds), Animal and
Human Health Hazards associated with the utilization of animal
efflents, EEC Publication, 21-23 Novembre 1978, Dublin, Ireland, pp
35-56.
Hedges J.D., Kornegay E.T., 1973. Interrelationship of dietary copper
and iron as measured by blood parameters, tissue stores and feedlot
performance of swine. J. Anim. Sci., 37, 1147-1154.
Héduit M., Roustan J.L., Aumaître A., Seguin M., 1977. Composition du
lisier de porc: influence du mode d'exploitation. J. Rech. Porcine en
France, 9, 305-310.
Hill G.M., Ku P.K., Miller E.R., Ullrey D.E., Losty T.A., O'Dell B.L.,
1983a. A copper deficiency in neonatal pigs induced by a high zinc
maternal diet. J. Nutr., 113, 867-872.
Hill G.M., Miller E.R., Whetter P.A., Ullrey D.E., 1983b. Concentration
of minerals in tissues of pigs from dams fed different levels of
dietary zinc. J. Anim. Sci., 57, 130-138.
Hill D.A., Peo E.R.J., Lewis A.J., Crenshaw J.D., 1986. Zinc-amino acid complexes for swine. J. Anim. Sci., 63, 121-130.
Ho S.K., Elliot J.I., 1974. Fatty acid composition of porcine depot fat
as related to the effect of supplemental dietary copper on the specific
activities of fatty acyl desaturase systems. Can. J. Anim. Sci., 54,
23-28.
INRA, 1989. L'alimentation des animaux monogastriques : porcs,
lapins, volailles. Institut National de la Recherche Agronomique,
Paris, 282 pp.
JORF, 1998. Arrêté du 8 janvier 1998 fixant les prescriptions
techniques applicables aux épandages de boues sur les sols agricoles
pris en application de décret n° 97-1153 du 8 décembre 1997 relatif à
l'épandage des boues issues du traitement des eaux usées. Journal
Officiel de la République Française, 31 janvier 1998, 1563-1571.
Kies C., Umoren J., 1989. Inhibitors of copper bioutilization: fibre,
lead, phytate and tannins. Adv. Exp. Med. Biol., 258, 81-93.
Kirchgessner M., Grassmann E., 1970. The dynamics of copper absorption.
In : C.F. Mills (eds), Trace Elements Metabolism in Animals,
Edinburgh, Livingstone, 277-287.
Kirchgessner M., Beyer M.G., Steinhart H., 1976. Activation of pepsin
(EC 3.4.4.1) by heavy-metals ions including a contribution to the mode
of action of copper sulfate in pig nutrition. Br. J. Nutr., 36, 15-22.
Kirchgessner M., Kreuzer M., Roth F.X., 1994. Alters- und
geschlechtsbedingte unterschiede in den Gehalte an Fe, Zn, Cu und Mn
verschiedener Körperpartien sowie ihre Retention bei Mastschweinen.
Arch. Anim. Nutr., 46, 327-337.
Kirchgessner M., Windisch W., Roth F.X., 1994. Zum Effekt mikrobieller
Phytase auf die scheinbare Verdaulichkeit von Eisen, Kupfer, Zink und
Mangan bei abgestufter P-Versorgung von Ferkeln. Agribiol. Res., 47,
156-159.
Kline R.D., Hays V.W., Cromwell G.L., 1972. Related effects of copper,
zinc and iron on performance, haematology and copper stores of pigs. J.
Anim. Sci., 34, 393-396.
Kornegay E.T., Heugten P.H.G., Lindemann M.D., Blodgett D.J., 1989.
Effects of biotin and high copper levels on performance and immune
response of weanling pigs. J. Anim. Sci., 67, 1471-1477.
Kratzer F.H., Vohra P., 1986. Chelates in nutrition. CRC Press, 169 pp.
L'Herroux L., 1997. Devenir des éléments métalliques provenant des
effluents d'elevage apportés aux parcelles agricoles. Etude du modèle
expérimental Solepur et cas de l'estuaire de l'Aber Wrach. Thèse
doctorat UBO, 211 pp.
Larsen T., Sandström B., 1993. Effect of dietary calcium level on
mineral and trace element utilization from rapeseed (Brassica napus L.)
diet fed to ileum-fistulated pigs. Br. J. Nutr., 69, 211-224.
Larsen T., Skoglund E., Sandberg A.S., Engberg R.M., 1999. Soaking and
pelleting of pig diets alters the apparent absorption and retention of
minerals. Can. J. Anim. Sci., 79, 477-483.
Lauridsen C., Hojsgaard S., Sorensen M.T., 1999a. Influence of dietary
rapeseed oil, vitamin E and copper on the performance and the
antioxidative status of pigs. J. Anim. Sci., 77, 906-916.
Lauridsen C., Nielsen J.H., Henckel P., Sorensen M.T., 1999 b.
Antioxidative and oxidative status in muscles of pigs fed rapeseed oil,
vitamin E and copper. J. Anim. Sci., 77, 105-115.
Lee G.R., Nacht S., Lukens J.N., Carttwright G.E., 1968. Iron
metabolism in copper deficient swine. J. Clin. Invest., 47, 2058-2069.
Lee S.H., Choi S.C., Chae B.J., Lee J.K., Acda S.P., 2001. Evaluation
of metal-amino acid chelates and complexes at various levels of copper
and zinc in weanling pigs and broiler chicks. Asian-Aust. J. Anim.
Sci., 14, 1734-1740.
Levasseur P., Texier C., 2001. Teneurs en éléments trace métalliques
des aliments et des lisiers de porcs à l'engrais, de truies et de
porcelets. Journées Rech. Porcine en France, 33, 57-62.
Lucas I.A.M., Calder A.F.C., 1957. A comparison of five levels of
copper sulphate in rations for growing pigs. Proc. Nutr. Soc., 16, i.
Luo X.G., Dove C.R., 1996. Effect of dietary copper and fat on nutrient
utilization, digestive enzyme activities, and tissue mineral levels in
weanling pigs. J. Anim. Sci., 74, 1888-1896.
Mahan D.C., Newton E.A., 1995. Effect of initial breeding weight on
macro- and micromineral composition over a three-parity period using a
high-producing sow genotype. J. Anim. Sci., 73, 151-156.
Mahan D.C., Shields R.G.Jr., 1998. Macro- and micromineral composition
of pigs from birth to 145 kilograms of body weight. J. Anim. Sci., 76,
506-512.
Mathé D., Guillou D., Flesselle S., 2001. Conséquences d'apports
réduits en cuivre dans l'aliment du porc en croissance finition.
Journées Rech. Porcine en France, 33, 37-42.
McGrath M.C., 1981. Implications of applying copper rich pig slurry to
grassland; effects on plant and soil. In : P. L'Hermite and J.
Dehandtschutter (eds), Copper in animal wastes ans sewage sludge, Proc.
EEC Workshop, INRA Publisher, 8-10 October 1980, Bordeaux, France, pp
144-153.
McGrath S.P., Chaudri A.M., Giller K.E., 1995. Long term effects of
metals in sewage sludge on soils, microorganisms and plants. J. Ind.
Microbiol., 14, 94-104.
Menten J.F.M., Ames N.K., Ku P.K., Miller E.R., 1988. Effects of high
dietary copper on blood and intestinal variables of stater pigs. J.
Anim. Sci., 66, 330 (Abstr.).
Mertz W., 1987. Use and misuse of balance studies. J. Nutr., 117, 1811-1813.
Mills C.F., 1985. Dietary interactions involving the trace elements. Ann. Rev. Nutr., 5, 173-193.
Morel J.L., 1997. Bioavaibility of trace elements to terrestrial
plants- Chapter 6. Tarradellas J., Bitton G., Rossel (eds). Soil
Ecotoxicology, Lewis Publihers, CRC Press, Boca Raton, F1, 141-176.
Moore R.J., Kornegay E.T., 1987. Effect of dietary mineral level and
duration of feeding on fiber digestibility and mineral utilization by
growing pigs fed high-fiber diets. Nutr. Rep. Intern., 36, 1237-1249.
Moore R.J., Kornegay E.T., Lindemann M.D., 1986. Effect of dietary oat
hulls or wheat bran on mineral utilization in growing pigs fed diets
with or without salinomycin. Can. J. Anim. Sci., 66, 267-276.
Moore R.J., Kornegay E.T., Grayson R.L., Lindemann M.D., 1988. Growth,
nutrient utilization and intestinal morphology of pigs fed high fiber
diets. J. Anim. Sci., 66, 1570-1579.
Newton G.L., Hale O.M., Plank C.O., 1983. Effect of wheat bran in
practical diets on mineral absorption by pigs at two ages. Can. J.
Anim. Sci., 63, 399-408.
NRC, 1998. Nutrient requirements of swine (10th Edition). National Academy Press, Washington, DC.
O'Dell B.L., 1981. Roles for iron and copper in connective tissue biosynthesis. Philos. Trans. R. Soc. London, 294, 91-104.
O'Dell B.L., 1989. Mineral interactions relevant to nutrient requirements. J. Nutr., 119, 1832-1838.
Okonkwo A.C., Ku P.K., Miller E.R., Keahey K.K., Ullrey D.E., 1979.
Copper requirements of baby pigs fed purified diets. J. Nutr., 109,
939-948.
Olivié-Lauquet G., Gruau G., Dia A., Riou C., Jaffrézic A., Hénin O.,
2000. Release of trace elements in wetlands : role of seasonal
variability. Water Res., 35, 943-952.
Omole T.A., Bowland J.P., 1974a. Copper, iron and managanese
supplementation of pig diets containing either soybean meal or low
glucosinolate rapeseed meal. Can. J. Anim. Sci., 54, 481-493.
Omole T.A., Bowland J.P., 1974b. Copper and zinc supplementation of pig
diets containing soybean meal or rapeseed meal (Brassica campestris vs
Span). Can. J. Anim. Sci., 54, 363-372.
Paboeuf F., Nys Y., Corlouër A., 2000. Réduction des rejets en cuivre
et en zinc chez le porc charcutier par la diminution de la
supplémentation minérale. Journées Rech. Porcine en France, 32, 59-66.
Paboeuf F., Calvar C., Landrain B., Roy H., 2001. Impact de la
réduction des niveaux alimentaires en matière azotée totale, en
phosphore en cuivre et en zinc sur les performances et les rejets des
porcs charcutiers. Journées Rech. Porcine en France, 33, 49-56.
Pallauf J., Rimbach G., 1997. Nutritional significance of phytic acid and phytase. Arch. Anim. Nutr., 50, 301-319.
Pallauf J., Höhler D., Rimbach G., 1992. Effekt einer Zulage an
mikrobieller Phytase zu einer Mais-Soja-Diät auf die scheinbare
Absorption von Mg, Fe, Cu, Mn und Zn sowie auf Parameter des Zinkstatus
beim Ferkel. J. Anim. Physiol. a. Anim. Nutr., 68, 1-9.
Percival S.S., 1998. Copper and immunity. Am. J. Clin. Nutr., 67, 1064S-1068S.
Pond W.G., Walker E.F.J., Kirtland D., 1975. Weight gain, feed
utilization and bone and liver mineral composition of pigs fed high or
normal Ca-P diets from weaning to slaughter weight. J. Anim. Sci., 41,
1053-1056.
Pond W.G., Yen J.T., Varel V.H., 1988. Response of growing swine to
dietary copper and clinoptilolite supplementation. Nutr. Rep. Intern.,
37, 795-803.
Poulsen H.D., 1998. Zinc and copper as feed additives, growth factors
or unwanted environmental factors. J. Anim. Feed Sci., 7, 135-142.
Powell J.J., Jugdaohsingh R.J., Thompson R.P.H., 1999. The regulation
of mineral absorption in the gastrointestinal tract. Proc. Nutr. Soc.,
58, 147-153.
Priem R., Maton A., 1980. The influence of the content of trace
elements in the feed on the composition of liquid manure of pig.
In : J.K.R Gasser (ed), Effluents from livestock, Applied Science
Publishers, Baking, pp 9-22.
Prince T.J., Hays V.W., Cromwell G.L., 1979. Effects of copper sulfate
and ferrous sulfide on performance and liver copper and iron stores of
pigs. J. Anim. Sci., 49, 507-513.
Prince T.J., Hays V.W., Cromwell G.L., 1984. Interactive effects of
dietary calcium, phosphorus and copper on performance and liver stores
of pigs. J. Anim. Sci., 58, 356-361.
Prohaska J.R., 1990. Biochemical changes in copper deficiency. J. Nutr. Biochem., 1, 452-461.
Radecki S.V., Ku P.K., Bennink M.R., Yokoyama M.T., Miller E.R., 1992.
Effect of dietary copper on intestinal mucosa enzyme activity,
morphology, and turnover rates in weanling pigs. J. Anim. Sci., 70,
-1431.
Ravindran V., Kornegay E.T., Webb K.E.J., 1984. Effects of fiber and
virginiamycin on nutrient absorption, nutrient retention and rate of
passage in growing swine. J. Anim. Sci., 59, 400-408.
Ribeiro de Lima F., Stahly T.S., Cromwell G.L., 1981. Effects of
copper, with or without ferrous sulfide and antibiotics on the
performance of pigs. J. Anim. Sci., 52, 241-247.
Richards M. P., 1999. Zinc, copper and iron metabolism during porcine fetal development. Biol. Trace Element Res., 69, 27-44.
Roof M.D., Mahan D.C., 1982. Effect of carbadox and various dietary
copper levels for weanling swine. J. Anim. Sci., 55, 1109-1117.
Shurson G.C., Ku P.K., Waxler G.L., Yokoyama M.T., Miller E.R., 1990.
Physiological relationships between microbiological status and dietary
copper levels in the pig. J. Anim. Sci., 68, 1061-1071.
Smith J.W., Tokach M.D., Goodband R.D., Nelssen J.L., Richert B.T.,
1997. Effects of the interrelationship between zinc oxide and copper
sulfate on growth performance of early-weaned pigs. J. Anim. Sci., 75,
1861-1866.
Solomons N.W., 1983. Competitive mineral-mineral interaction in the
intestine. Implications for zinc absorption in humans. In : E.G.
Inglett (eds), Nutritional bioavailability of zinc, American Chemical
Society, Washington, DC, 247-271.
Stansbury W.F., Tribble L.F., Orr D.E.J., 1990. Effect of chelated
copper sources on performance of nursery and growing pigs. J. Anim.
Sci., 68, 1318-1322.
Strain J.J., 1994. Newer aspects of micronutrients disease: copper. Proc. Nutr. Soc., 53, 583-598.
Suttle N.F., Mills C.F., 1966a. Studies of the toxicity of copper to
pigs. 1. Effects of oral supplements of zinc and iron salts on the
development of copper toxicosis. Br. J. Nutr., 20, 135-148.
Suttle N.F., Mills C.F., 1966b. Studies of the toxicity of copper to
pigs. 1. Effect of protein source and other dietary components on the
response to high and moderates intakes of copper. Br. J. Nutr., 20,
149-161.
Underwood E.J., 1977. Copper. In : Trace Elements in Human and
Animal Nutrition, Ed. 4, Academic Press, Inc, London, UK, 56-108.
Underwood E.J., Suttle N.F., 1999. Copper. In : The mineral
nutrition of livestock. Ed. 3, CABI Publishing, Wallingford,UK,
283-342.
Varel V.H., Robinson I.M., Pond W.G., 1987. Effect of dietary copper
sulfate, aureo SP250, or clinoptilolite on ureolytic bacteria found in
the pig large intestine. Appl. Environ. Microbiol., 53, 2009.
Ward T.L., Watkins K.L., Southern L.L., Hoyt P.G., French D.D., 1991.
Interactive effects of sodium zeolite-A and copper in growing swine:
growth, and bone and tissue mineral concentrations. J. Anim. Sci., 69,
726-733.
Windisch W.M., Gotterbarm G.G., Roth F.X., 2001. Effect of potassium
diformate in combination with different amounts and sources of
excessive dietary copper on production performance in weanling piglets.
Arch. Anim. Nutr., 54, 87-100.
Wise A., Gilburt D., 1982. In vitro competition between calcium phytate
and the soluble fraction of rat small intestine contents for cadmium,
copper and zinc. Toxicol. Lett., 11, 49-54.
Yeates G.W., Orchard V.A, Speir T.W., Hunt J.L., Hermans M.C. 1994.
Impact of pasture contamination by copper, chromium, arsenic and timber
preservative on soil biological activity. Biology and Fertility of
soils, 18, 200-208.
Yen J.T., Nienaber J.A., 1993. Effects of high-copper feeding on portal
ammonia absorption and on oxygen consumption by portal vein-drained
organs and by the whole animal in growing pigs. J. Anim. Sci., 71,
2157-2163.
Yen J.T., Pond W.G., 1993. Effects of carbadox, copper, or Yucca
schidigera extract on growth performance and visceral weight of young
pigs. J. Anim. Sci., 71, 2140-2146.
Yu B., Beynen A.C., 1994. High zinc reduces biliary copper excretion in rats. J. Anim. Physiol. a. Anim. Nutr., 72, 169-175.
Zhou W., Kornegay E.T., van Laar H., Swinkels J.W.G.M., Wong E.A.,
Lindemann M.D., 1994a. The role of feed consumption and feed efficiency
in copper-stimulated growth. J. Anim. Sci., 72, 2385-2394.
Zhou W., Kornegay E.T., Lindemann M.D., Swinkels J.W.G.M., Welten M.K.,
Wong, E.A., 1994b. Stimulation of growth by intravenous injection of
copper in weanling pigs. J. .Anim. Sci., 72, 2395-2403.
Abstract
Copper in pig nutrition: essential trace element, growth promoter, and
its potential adverse effects on human nutrition and environment.
Copper is essential for many physiological
functions including iron metabolism, immunity and protection of tissues
from oxidative stress. Liver plays a key role in maintaining copper
homeostasis and adjustment to fluctuation of copper supply is mainly
achieved by liver storage and biliary secretion. The copper
requirements of the growing pig are below 10 mg/kg feed. They are
normally covered by the feedstuff copper provision and any
supplementation is theoretically superfluous. However, because of the
growth promoting effect of copper, 150 to 250 ppm supplements are often
added in diets of weaned piglet. When this supply of copper is omitted
at the end of the post-weaning period, such a dietary copper supply
does not influence the copper content of the meat consumed by humans.
However, it induces an increase of copper content in pig slurry and,
consequently, an accumulation of copper in soils.
The reduction of dietary copper supply close to the requirements is the
main way to better control this environmental risk. However, to achieve
this goal, the dietary factors that may significantly influence the
availability of copper should be accurately known and ranked. Some
chelating agents, such as phytates, fibres or fat as well as the level
of other minerals such as Zn and Ca may interfere on copper
availability. However their actual impact remains to be assessed. In
addition, relevant indicators of copper status should be chosen to
implement these investigations.
|